Genetica e Trasferimento Genico in Oncologia
Attività di ricerca
Nell'ambito della SC Core Research Laboratory le attività rientranti in "Genetica e Trasferimento Genico in Oncologia" sono incentrate sullo studio dei vari aspetti genetici delle malattie clonali con particolare interesse nell’identificazione e caratterizzazione dei fattori, ereditari ed acquisiti, che favoriscono l’emergenza e l’espansione di popolazioni clonali anormali che causano malattie. L'obiettivo è quello di studiare in laboratorio le problematiche che nascono dall’osservazione clinica del paziente e di trasferire al paziente i risultati delle ricerche in un continuo andirivieni “from bedside to bench” e viceversa.
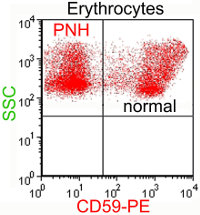
1. Clonalità: il modello emoglobinuria parossistica notturna
L'emoglobinuria parossistica notturna (EPN) è una rara malattia clonale acquisita del sangue caratterizzata da emolisi intravascolare complemento-mediata, elevato rischio trombotico e citopenie multiple. L'EPN è dovuta all'espansione clonale di una cellula staminale ematopoietica con una mutazione somatica del gene PIGA che provoca l'assenza di tutte le molecole legate alla membrana cellulare tramite l’ancora glicofosfaditilinositolica (GPI). L’EPN è considerata una malattia clonale non-maligna ma può, in casi relativamente rari, evolvere in leucemia. Inoltre, gli studi di sequenziamento globale hanno dimostrato che nell’EPN sono presenti cloni con mutazioni ricorrenti in geni coinvolti nella patogenesi delle neoplasie mieloidi. La peculiarità dell’EPN di essere una malattia clonale allo stretto confine tra neoplasie benigne e maligne ne fa un modello unico per lo studio dei fattori che determinano l’espansione e la trasformazione clonale.
La mutazione del gene PIGA spiega la suscettibilità al complemento delle cellule EPN e quindi emolisi e trombosi, ma non spiega l‘espansione del clone mutato. Un modello plausibile per spiegare questa espansione è che le cellule staminali ematopoietiche normali siano il bersaglio di un attacco autoimmune selettivo a cui quelle EPN siano resistenti. Il nostro laboratorio ha dimostrato che nei pazienti EPN sono significativamente aumentate le popolazioni di linfociti T che, tramite TCR, riconoscono il GPI presentato dal CD1d e che producono interferone gamma (IFNγ) in risposta al GPI. Quindi, le cellule staminali ematopoietiche normali (GPI+), riconosciute dal TCR contro il GPI presentato dal CD1d, sono distrutte/inibite selettivamente dall’IFNγ, mentre le cellule staminali ematopoietiche normali EPN (GPI-negative) non sono riconosciute e, quindi, risparmiate. Meccanismi autoimmuni simili potrebbero anche essere responsabili dell'espansione clonale in altre citopenie clonali acquisite, come le sindromi mielodisplastiche che evolvono frequentemente in leucemia acuta.
Dal punto di vista clinico, l’introduzione della terapia mirata (target therapy) con un anticorpo monoclonale umanizzato che blocca la componente 5 del complemento (C5), eculizumab, ha modificato sostanzialmente la storia natura dell’EPN. L’eculizumab riduce efficacemente l’emolisi intravascolare e le sue conseguenze, incluso il rischio trombotico, e ciò si è tradotto nel miglioramento della qualità e dell’aspettativa di vita dei pazienti EPN. Tuttavia, abbiamo scoperto che in quasi tutti i pazienti EPN trattati con eculizumab i globuli rossi EPN vengono ricoperti da frammenti della componente 3 del complemento (C3) che li rende suscettibili a gradi variabili di emolisi extravascolare che, in alcuni pazienti, può ridurre i benefici clinici. Negli ultimi anni abbiamo definito la farmacogenetica di questo fenomeno e abbiamo partecipato alla caratterizzazione preclinica d’inibitori della via alternativa del complemento che dovrebbero migliorare la risposta e che ora sono nella fase della sperimentazione clinica.
2. Tasso di mutazioni somatiche e cancro
L’accumulo di un numero discreto di mutazioni somatiche è alla base della trasformazione di una cellula normale in una neoplastica. Pertanto, il tasso individuale di mutazioni somatiche spontanee (μ), fenomeno intrinseco della duplicazione cellulare, è verosimilmente un fattore di rischio per lo sviluppo di qualsiasi tipo di tumore. Il gene X-legato PIGA può essere usato come gene sentinella per studiare l’emergenza di mutazioni somatiche, poiché la mutazione dell’unica copia attiva determina cellule con fenotipo di membrana GPI-negativo che è possibile quantificare in citometria a flusso. Al fine di studiare la relazione tra tasso di mutazioni e tumori, abbiamo misurato la frazione (ƒ) di granulociti del sangue mutati in PIGA. La misura di ƒ si è dimostrata riproducibile, nei soggetti sani ƒ ha un valore mediano di 4,9/milione di granulociti (0,75 – 32) ed ha una distribuzione log-normale. Attualmente, stiamo studiando se ƒ correla con il rischio di cancro sporadico. Risultati preliminari in pazienti con sindromi mieloproliferative croniche (SMP) indicano che i pazienti con SMP ed almeno un altro tumore maligno primario hanno ƒ più elevata di quelli con SMP "isolata". Questo dato corrobora l’ipotesi che un tasso di mutazione intrinsecamente aumentato gioca un ruolo significativo nel rischio tumorale, specialmente nei soggetti con tumori primari multipli.
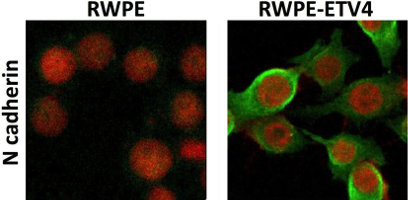
3. Proteine ETS nel carcinoma della prostata
Nella grande maggioranza dei carcinomi prostatici sono presenti traslocazioni che coinvolgono geni della famiglia ETS. Queste traslocazioni giustappongono uno dei geni ETS (ERG, ETV1, ETV4, ecc.) al promotore di geni normalmente espressi nella prostata: ciò determina l’espressione aberrante del gene ETS nelle cellule prostatiche. Tra le proteine ETS, il nostro laboratorio si è concentrato su ETV4 ed ha identificato vari meccanismi attraverso cui determina e influenza il fenotipo neoplastico delle cellule prostatiche. In particolare, abbiamo trovato che l’espressione di ETV4 in linee cellulari prostatiche determina modifiche morfologiche funzionali tipiche della "transizione epitelio-mesenchimale" (EMT) e che, a differenza delle altre proteine ETS, svolge un ruolo importante anche nella proliferazione cellulare e nella progressione del ciclo cellulare. Considerando l'ampia variabilità del decorso clinico dei pazienti con carcinoma prostatico, è interessante che ETV4 sia in grado di indurre la maggior parte delle caratteristiche associate all'aggressività del tumore. Attualmente stiamo studiando gli effetti in vivo dell'espressione di ETV4 nella prostata di un modello di topo transgenico e stiamo investigando il possibile ruolo di ETV4 nel controllo dell’infiammazione.
Per saperne di più
dott. Rosario Notaro
email: r.notaro@ispro.toscana.it
ORCID ID: 0000-0002-9087-9404
Indirizzo
CRL-ISPRO
Viale Pieraccini 6
Cubo 3, I piano
50139 Firenze
Tel.: +39 055 7944567














